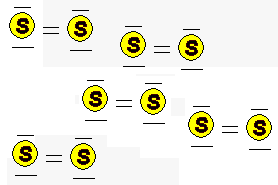| Durchführung: |
- |
Drei Zentimeter Schwefelblume wird im
Reagenzglas sehr (!) langsam bis zum Siedepunkt erhitzt und die Temperatur
dabei kontrolliert. Achtung: Die entweichenden Gase nicht am Brenner
entzünden! Wird trotzdem giftiges Schwefeldioxid wahrgenommen, muss die Flamme mit
einem feuchten Papiertuch erstickt werden. |
Der siedende Schwefel wird schnell in kaltes
Wasser gegossen |
Die Fäden werden mit den Fingern entnommen
und gedehnt. |
|
Deutung:
|
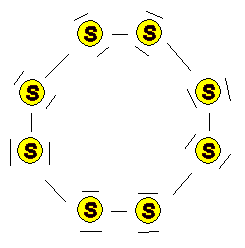
Ringförmige Moleküle der Formel S8
befinden sich in einem regelmäßigen Kristallgitter |
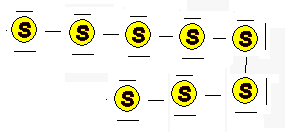
Die S8 - Ringmoleküle
verlassen ihre Gitterplätze und sind frei beweglich |
Die Ringmoleküle zerbrechen durch die
heftigere Bewegung zu kurzen Fäden (Die Endatome liegen als Radikale vor). |
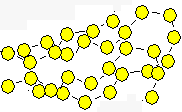
Die Molekülketten verbinden sich zu langen
Ketten und verknäulen sich. Die Bindungselektronen absorbieren mehr Licht. |
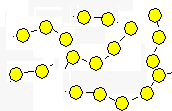
Die hohe Temperatur bewirkt ein Zerbrechen
der Molekülketten beim Zusammenprall. Die Bruchstücke sind unterschiedlich
lang. |
Die Kettenlänge nimmt ab. Die Flüssigkeit
wird damit dünnflüssiger. In den Gasraum entweichen S2
- Moleküle. |
Die Struktur der langen Molekülketten wird
erhalten, gasförmiger Schwefel resublimiert auf dem kalten Wasser. |
Der plastische Schwefel behält einige Tage
die elastische Struktur der verknäulten Ketten |