Gymnasium Ohmoor - Profilkurs Chemie im 1. Semester - © C.-J. Bautsch PK Chemie 19. Dezember 2009
Die Absorption von Infrarotstrahlung durch Kohlendioxid
Die Grundlagen zum folgenden Versuch haben wir der Zeitschrift "Chemikon", Ausgabe 1/1996 entnommen (I. Parchmann und W. Jansen, S. 8)
Als Lichtquelle dient ein alter Diaprojektor. Die Strahlung wird durch ein Wasserbecken und dann in eine mit Schaumstoff isolierte PE- Flasche (abgeschnittene dest.-Wasserflasche) geschickt.
Am Boden der Flasche befindet sich eine Scheibe aus schwarzem Karton. PE-Flasche und Isolierung werden hier von einer Blechdosenummantelung gehalten. Ein Haushaltsfolie, gehalten mit einem Gummiring, verschließt das Gefäß.
In das Gefäß ragt ein elektrischer Thermofühler, wobei die Spitze ca. 1cm über die Mitte der schwarzen Pappscheibe ragt. Die Dose wird mit reinen Gasen aus Flaschen gefüllt.
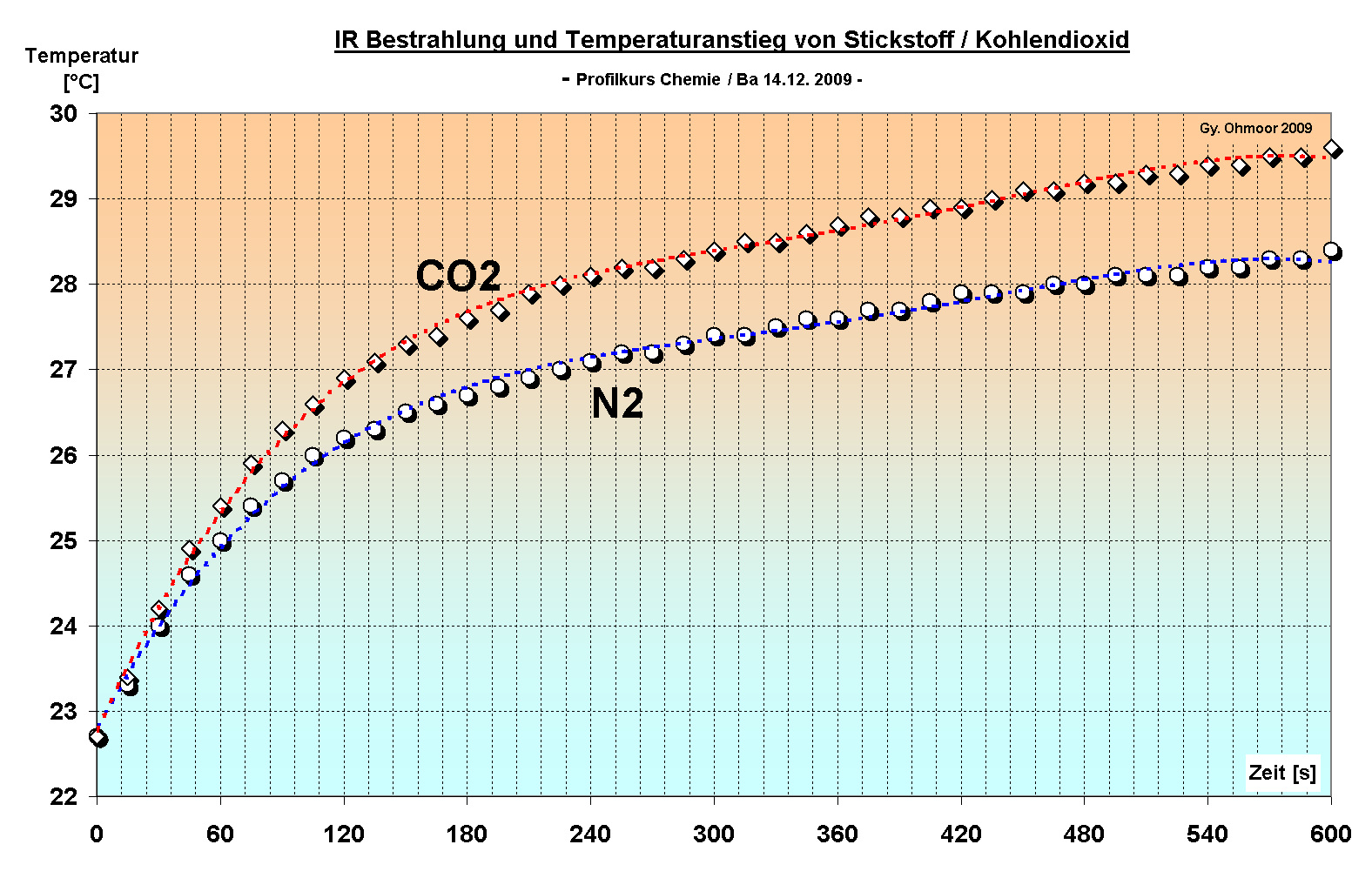
Die Messdaten sind in folgender Excel-Tabelle abrufbar. Der Temperaturversatz von Stickstoff wurde in einer Extra-Spalte herausgerechnet.
Hier die Tabellendaten als Excel-File zum Download:
Der Diaprojektor simuliert die Sonnenstrahlung. Das Wasserbecken vermindert die Infrarotanteile, so dass ein dem Sonnenspektrum ähnliches Licht die Dose erreicht. Auch eine denkbare, direkte Wärmeübertragung (Translation) wird so vermieden. Die schwarze Pappe wirkt ähnlich wie die Erdoberfläche, nur dass die Absorption eines schwarzen Körpers stärker ist. Die Folie am Lichteintritt wirkt in gewisser Weise wie die Gravitation der Erde: sie verhindert, dass Gasteilchen sich entfernen. Verglichen werden zwei trockene Gase, direkt aus der Flasche. Somit stören keine Wasserdampfanteile, wie sie z.B. immer in der Luft vorhanden sind.
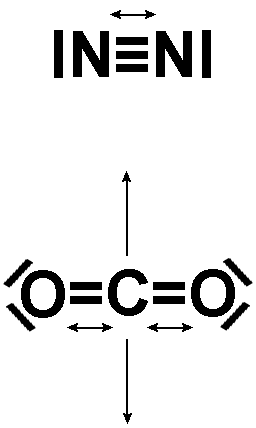
Über 10 Minuten ergab sich etwa eine Temperaturerhöhung von 6 Grad Celsius. In der mit Kohlendioxid gefüllten Dose war die Erwärmung erkennbar schneller. Die Differenz betrug etwas mehr als ein Grad. Ursache ist die Möglichkeit des CO2 Moleküls Infrarotstrahlung über Schwingungen des C-Atoms (hier senkrechte Pfeile) im elastischen Verband aufzunehmen. Die verstärkte Bewegung erhöht die Bewegungsenergie des gesamten Teilchens und damit die Temperatur. Das Stickstoffmolekül besteht nur aus zwei Atomen, das auch noch mit einer Dreifachbindung sehr starr aufgebaut ist, zumindest, was die Reaktion auf bestimmte Infrarotstrahlungsanteile betrifft. Der Anstieg kann nicht linear sein, da die Abstrahlungsverluste aus der Dose beim Temperaturanstieg zunehmen. Ein Energiegleichgewicht stellt sich ein, die "Atmosphärentemperatur".
Der Versuch zeigt, dass schwingungsfreudige Moleküle, wie Kohlendioxid die Wärmeabstrahlung der Erdoberfläche nicht so ungehindert passieren lassen, wie die Hauptbestandteile der Luft, Stickstoff und Sauerstoff. Das Experiment ist also geeignet, messtechnische Erfahrungen zum Treibhauseffekt zu sammeln.
