Versuchsprotokoll: Eigenschaften von Kristallviolett bei pH-Wert - Änderungen
Durchführung:
Leistungskurs Chemie 2008
20 Milligramm Kristallviolett werden in 500ml ein molarer
Salzsäure gelöst.
Je 100ml davon werden mit 1m Natronlauge bis zu den pH-Werten 1, 1,35,
2,2, ca. 11 und 13 titriert. Die Mischung ist wieder auf 100ml mit Wasser
aufzufüllen. In einem 6. Becherglas löst man eine große Spatelspitze (ca.
100mg) Kristallviolett direkt in 100ml 15%iger Salzsäure. Das Milieu wird mit einem pH-Meter
bestimmt. Die Farbe wird vor einer Milchglasscheibe mit
Halogenlampen-Hintergrund und nach erfolgtem Weißabgleich mit einer DSLR-Kamera
dokumentiert. Ein digitales Spektralfotometer ermittelt die Extinktionskurve.
Achtung:
Die konzentrierten Säuren und Laugen sind sehr ätzend!
Beobachtungen bei Zugabe von Natronlauge ==>
Foto
groß:
bitte an-
klicken
Sichtbare Farbe
(bei 0,1mmol / und pH 0: gelb!)
VIS
Spektrum
Messwerte
hier als
Excel-File
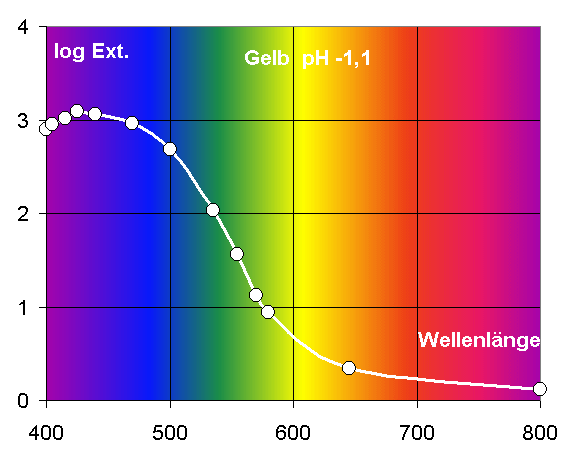
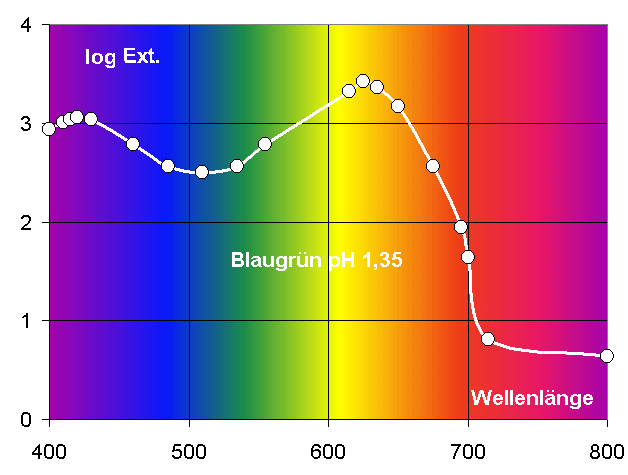
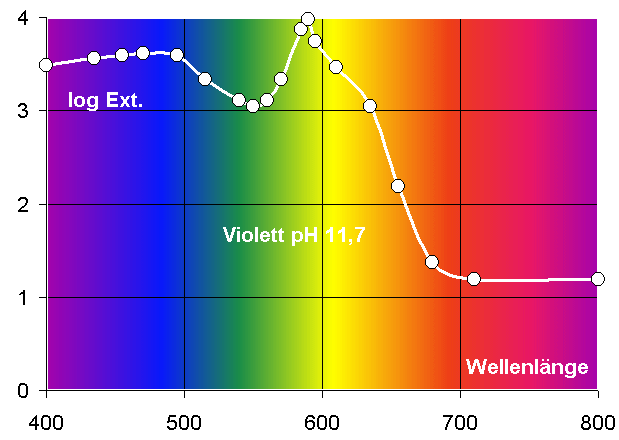
im Fotometer
Absorbierte Farbe
Deutung:
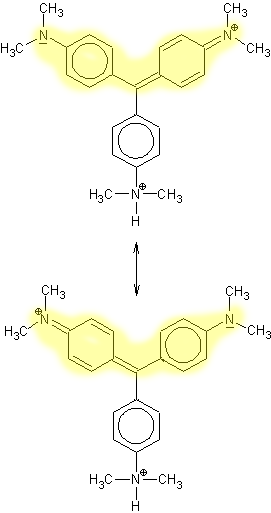
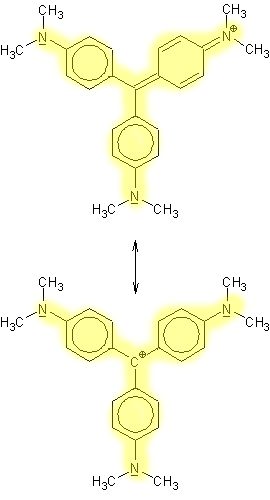
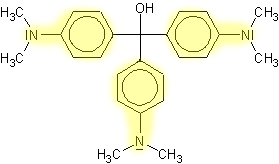
Struktur der Teilchen:
gleichwertige Grenzstruk-
turbereiche
sind gelb hinterlegt
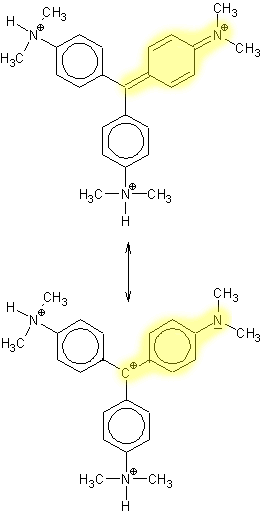
Gemisch
Gemisch
Effekte:
Gemisch aus Struktur
I und III
Der pKs-Wert liegt
laut Literatur* bei 0,8
Zwei gleichwertige Grenzstrukturen (ein T-Chromophor) und ein kaum vom unteren Phenylring beeinflusstes, zentrales C-Atom bilden eine besonders geringe Differenz zwischen bindenden (HOMO) und antibindenden (LUMO) Pi-Orbitalen.
Gemisch aus Struktur
III und IV
Der pKs-Wert liegt
laut Literatur* bei 2,6
Ergebnis:
Fotos: W.-L. Hellweg / Y. Wencke, Formeln: S. Zeller / T. Hinz, Fotometrische Messungen: B. Stiller / S. Räther (Gy. Bondenwald), pH-Wert Messungen: N. Jansen / T. Heydecke / J. Lüder
*) W. Kratzert, R. Peichert.
Farbstoffe. Heidelberg 1981
© C.-J.Bautsch
5.10. 2008