AK Computer im Chemieunterricht, Klasse 10d am
Gymnasium Ohmoor, Hamburg, 15. Februar 1999
von Carl-Jürgen
Bautsch
Protolyse der
Schwefelsäure beim Verdünnen mit Wasser
Geräte und Chemikalien: 50ml Becherglas, 150ml
Becherglas, Bürette, Glaswanne, Magnetrührer, Thermometer, Transformator,
Leitfähigkeitsmeßstaab, 50ml Bürette, 10ml Pipette, Stativ, Experimentierkabel,
Messinterface, PC, 97% Schwefelsäure, dest. Wasser.
Durchführung: In ein hohes, 50ml-Becherglas wird
10ml H2SO4 mit einer Pipette vorgelegt. Das becherglas wird
in eine Glaswanne mit Kühlwasser gestellt, darunter befindet sich ein Magnetrührer. Bei
3 Volt wird im 200mA Wechselstrombereich des Interface der Stromfluß gemessen. In 9
Schritten wird dann aus einer Bürette Wasser zugetropft bis 10 Volumenprozent
erreicht sind. Anfangs wird ein kleines Becherglas verwendet um eine große
"Tauchtiefe" füe Elektroden und Rührstab zu gewähleisten. Vor den letzten
Verdünnungen ist in ein größeres becherglas umzufüllen. Die Zugabemenge errechnet sich
aus: Vz = Zugabemenge Wasser, Ca = Anfangskonzentration, Cx = gewünschte Konzentration,
Va = Ausgangsvolumen
Formel: Vz = (Ca / Va) * Va - Va
Gleichzeitig wird die Temperaturentwicklung kontrolliert. Damit das
Gemisch nicht zu heiß wird, muß nach jedem Verdünnungsschritt entsprechend gewartet
werden.
Beobachtungen: Bei der Verdünnung nimmt die
Temperatur zu, bis zu einer Konzentration von 40% steigt die Stromstärke um bei noch
stärkerer Verdünnung wieder zurückzugehen:
Wert |
Konz. |
Vol. |
+ H 2O |
Strom |
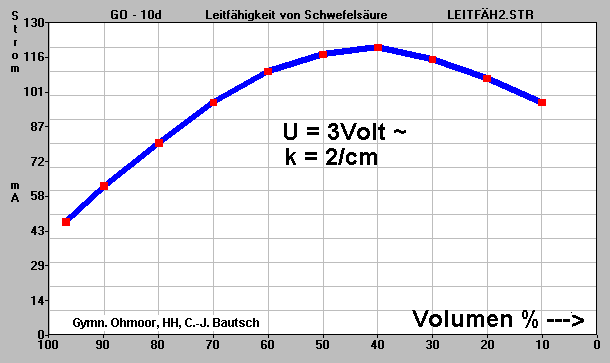 |
Nr. |
% (Ca) |
ml (Va) |
ml (Vz) |
mA |
1 |
97,0 |
10,0 |
0,0 |
47 |
2 |
90,0 |
10,0 |
0,8 |
62 |
3 |
80,0 |
10,8 |
1,4 |
80 |
4 |
70,0 |
12,1 |
1,7 |
97 |
5 |
60,0 |
13,9 |
2,0 |
110 |
6 |
50,0 |
15,9 |
3,2 |
117 |
7 |
40,0 |
19,1 |
8,8 |
120 |
8 |
30,0 |
27,8 |
9,3 |
115 |
9 |
20,0 |
37,1 |
18,5 |
107 |
10 |
10,0 |
55,6 |
- |
97 |
Ergebnisse: Schon die 97% Schwefelsäure
ist etwas dissoziiert. Die enthaltene Wassermenge erzeugt soviele Hydronium- und
Hydrogensulfat- bzw. Sulfationen, daß ein deutlicher Stromfluß resultiert. Die höchste
Ionenkonzentration und damit auch die beste Leitfähigkeit müsste sich eigentlich bei
einer 60%igen Säure ergeben:
Gleichung:
H2SO4 + 2H2O
=======> 2 H3O+
+ SO42-
Molzahl (n):
1
2
Molmasse: (M in g)
98
18
Masse (m = n * M in g):
98
36
Dichte: (d in g/ml)
1,8
1,0
Volumen: (V = m / d in ml)
54,4
36 ========>
90,4
% theoretisch:
60
40
100
% gemessen, höchste el Lf.
40
60
Bevor das Wasser aber nur noch verdünnend wirkt,
also die Protolyse alle Schwefelsäureteilchen erfasst hat, muss offensichtlich deutlich
stärker, bis auf etwa 40% verdünnt werden. Die Gleichgewichtslage erlaubt vorher
keine, wie in der Reaktionsgleichung angenommene, vollständige Reaktion.
Sicherheit: Gegen den
Grundsatz "Niemals Wasser in die Säure, sonst geschieht das Ungeheure"
wird hier verstoßen! Die Problematik muss also mit den Schülerinnen und Schülern
diskutiert werden. Bei unzureichender Kühlung erhitzt sich das Becherglas schnell über
50°C, was die Gefahr verdeutlicht.
© C.-J. Bautsch 15. Februar
1999
