
AK Computer im Chemieunterricht, Klasse 9d am Gymnasium Ohmoor, Hamburg 23. März 1998
Kupfersulfidsynthese und das Gesetz der konstanten Proportionen
von Carl-Jürgen
Bautsch
Bei der Dokumentation halfen mit: Franziska Schnoor, Eike Donker und Tobias Demian.
Die einfache Synthese von Kupfer und Schwefel bietet für Mittelstufenschüler die Möglichkeit, chemische Grundgesetze am Schülerversuch kennen zu lernen. Es wird vorweg die Masse eines Kupferblechs bestimmt, die Synthese mit Schwefel (im Überschuss) durchgeführt und das Produkt erneut gewogen. Vor über 200 Jahren hat John Dalton solche Versuche durchgeführt, um den Gesetzen der Massenverhältnisse bei chemischen Reaktionen auf die Spur zu kommen. Das Nachvollziehen solcher Messungen bietet mehrere didaktische und methodische Vorteile:
Es hat sich bewährt, die denkbaren Versuchsergebnisse in einer Vorbereitungsstunde anhand der Werteverteilung in einem XY-Diagramm zu diskutieren:
Zur Vorarbeit gehört auch die Demonstration des Versuches durch den Lehrer. Bei genügend Zeit können die Kupferbleche schon abgewogen und die Reagenzgläser mit etwas Schwefelblüte gefüllt werde.
Am Ende der Schülerpraktikums kommt das Programm des Arbeitskreise Computer im Chemieunterricht (AK) "UNIAUS für Windows" zum Einsatz. Die Schüler tippen ihre Meßwerte ein. Es kann auch eine elektronische Waage mit Interface zum Computer für diesen Versuch eingesetzt werden. Das bietet aber gegenüber dem Eintippen der Daten kaum Vorteile. In einer Auswertungsstunde erarbeiten die Schüler im Computerraum das Diagramm mit der Regressionsgeraden. Sie sollen geschickte Achseneinteilungen wählen, die Geradenfunktion berechnen und zeichnen lassen sowie das ganze sinnvoll beschriften. Natürlich soll auch die Wahl der Hintergrundfarben usw. nicht zu kurz kommen. Es wird für jeden Teilnehmer schließlich ein farbiges Diagramm für sein "Laborjournal" ausgedruckt und im Sinne der o.g. Thesen diskutiert.
Versuchsdurchführung:
Material: Schwefelblume, Kupferblech, Reagenzglas, Reagenzglashalter,
Schere, Pinzette, genaue Waage, Spatel, Brenner
In das RG wird ca. cm hoch Schwefel eingefüllt. Ein etwa 1 bis 2 cm breites und 2 bis
5 cm langes Stück Kupferblech wird ausgeschnitten, die genaue Masse bestimmt und im oberen
Teil des waagerecht gehaltenen RGs positioniert. Zunächst wird das
Kupferblech etwas vorgewärmt, dann der Schwefel kräftig erhitzt. Beim Sieden
wird dann auch abwechselnd das Kupferblech hoch erhitzt bis es - umgeben vom
Schwefeldampf - rot durchglüht. Nach
erfolgtem Umsatz soll der Schwefel erkalten während das Reaktionsprodukt noch weiter
erhitzt wird! Das verhindert die Resublimation von Schwefel auf dem Produkt.
Das noch heiße Syntheseprodukt wird wiederum gewogen. Unter zwei Vorraussetzungen sind
die Daten verwertbar: Es darf sich im Inneren kein unumgesetztes, biegsames Kupfer mehr
befunden haben und es dürfen keine Schwefelreste anhaften (ergibt zu niedrige/hohe
Massen!).

Beobachtungen:
Der Schwefel wird flüssig und zunehmend dunkelbraun bis er siedet. Weiter oben
sammeln sich Ablagerungen. Das Kupferblech wird nahezu schwarz und glüht plötzlich auf.
Die Glut setzt sich durch das ganze Blech fort. Der überschüssige Schwefel erkaltet zu
einer braunen Masse. Das Produkt ist blauschwarz - glänzend und porös.
Tabelle mit den Messergebnissen vom 19.12.1997, Klasse 9d |
||||||||||||||
Versuch Nr.: |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
Masse Kupfer [g] |
0,35 |
0,50 |
0,24 |
0,80 |
0,14 |
0,30 |
0,35 |
0,30 |
0,19 |
0,21 |
0,42 |
0,74 |
1,04 |
0,27 |
| Masse Kupfersulfid [g] | 0,57 |
0,68 |
0,33 |
0,95 |
0,19 |
0,47 |
0,49 |
0,39 |
0,25 |
0,27 |
0,51 |
0,94 |
1,22 |
0,33 |
Versuchsdeutung und Ergebnisse:
Kupfer und Schwefel reagieren zu Kupfersulfid:

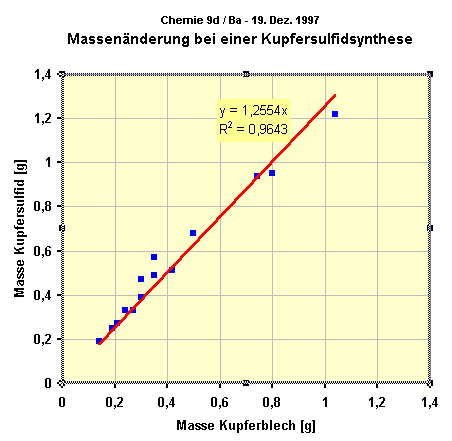
Die Regressionsgerade der Werte zeigt unter Berücksichtigung des Nullpunktes die
Funktion y = 1,255x an. Die Korrelation ist mit 0,96 brauchbar. Das Massenverhältnis
Kupfer zu gebundenem Schwefel lautet also etwa 1Cu : 0,255S.
Die Schüler haben meist nach einem halben Jahr Chemieunterricht noch keine Erfahrungen
mit der Ermittlung der Teilchenverhältnisse in festen Verbindungen. Auch Dalton kam
seinerzeit vielfach zu falschen Relationen bei der Bestimmung der Massenverhältnisse
zwischen den Elementen, weil er diese Zusammenhänge noch nicht untersucht hatte oder sie
zu seiner Zeit überhaupt noch unbekannt waren. Später konnten seine Massenangeben (z.B.
für Sauerstoff) verbessert werden. Hier muss nun im Unterricht die Information
eingebracht werden, dass sich immer zwei Anteile Kupfer an einen Anteil Schwefel binden.
Mit 2 dividiert korrigiert sich so die Kupfermasse auf 0,5Cu : 0,255S oder 1Cu
: 0,510S. Damit stellt sich heraus, dass die Kupferteilchen ungefähr
doppelt soviel Masse aufweisen wie die Schwefelteilchen.
Kritik:
Die Orientierung der Messergebnisse, sprich Punkte an einer
Geraden wird bei diesem Versuch immer deutlich. Das zeigen Vergleiche mit den
Messergebnissen mehrerer Jahrgänge. Das Gesetz der konstanten Proportionen kann also an
den Messergebnissen erkannt werden. Wird der Schwefel aber nicht ausreichend vor erhitzt,
so scheinen Konkurrenzreaktionen abzulaufen, die zu stöchiometrisch unklaren Gemischen
führen. Generell besteht das Problem einer zu großen Massenzunahme (z.B. 1Cu : 0,3S).
Die Oxidbildung als Ursache scheidet aus, da Kupfer-II-oxid mit 1Cu : 0,252S nahezu die
gleiche Massenrelation hat, wie Kupfer-I-sulfid und Kupfer-I-oxid sogar niedrigere
Massenzunahmen bewirken würden (1 Cu : 0,125). Auch die Röstreduktion mit Sauerstoff
sollte hier nicht stören, weil sie nicht zu niedrigeren Massenzunahmen führen kann. Als
Konkurrenzreaktion ist also die Bildung des schwarzen Kupfer-II-sulfides mit einer
Massenzunahme von 1Cu : 0,504S zu vermuten. Ein entscheidender Effekt könnte aber auch
von der Resublimation gasförmigen Schwefels in der Abkühlphase auf dem Produkt ausgehen.
Die Schüler sollten also im Umgang mit Reagenzglas und Bunsenbrenner geübt sein und sich
genau an die Durchführungs - Tipps halten!
Eine erhebliche didaktische Verbesserung ergäbe sich natürlich, wenn Bedingungen
geschaffen würden, die zu einer Kupfer-I-sulfidsynthese also im Teilchenverhältnis 1 : 1
führten.
C .- J. Bautsch, 1998 (Bearbeitet 18. Mrz. 2007).