Versuch: Blaufärben mit Indigo
(für eine kleine Anfärbeprobe)
27 g Baumwolle
2 g Indigo
3 ml Natronlauge (35%ig)
5 g Natriumdithionit
1,5ll Wasser 40°C
2 ml Ammoniak (25%ig)
Geräte:
Bunsenbrenner oder Heizplatte, Becherglas, Waage, pneumatische Wanne, Spatel, Pipetten, Glasstab zum Rühren, mehrere kleine Bechergläser für die Chemikalien, Wäscheleine, Wäscheklammern, Thermometer

Man gibt alle Chemikalien nacheinander, außer der Baumwolle, in
ein Gefäß. Dieses steht auf einer Heizplatte, damit das Gemisch
eine gleichmäßig hohe Temperatur (> 40°C) beibehält.
Diese Lösung wird nun noch mit ein wenig Spülmittel versehen,
damit das wasserunlösliche Indigo eine Suspension bilden kann. Nun
muss das Gemisch langsam (damit nicht zuviel Sauerstoff hinzugefügt
wird: siehe Redoxreaktion) gerührt werden, bis sich an der Oberfläche
eine kupferfarbene Blume bildet. Nun kann die gut durchfeuchtete Baumwolle
zum Färben in die Küpe gelegt werden. Abgebundene Knoten verhindern,
dass die Küpe überall gleichmäßig herankommt. So können
Strukturen und Muster erzeugt werden (s. unten)

Als alle Chemikalien zusammengegeben wurden, ist die Lösung
"schmutzig" braun. Durch das langsame Rühren bildet sich eine
kupferfarbene Schicht (Blume) an der Oberfläche der Lösung. Nachdem die
Baumwolle in die Küpe hineingelegt wurde, konnte man beobachten, dass die Küpe
immer noch die gleiche Farbe aufweist. Erst nach einiger Zeit (ca. 5- 8 min)
wird die Lösung gelblich klar und man sieht die Baumwolle durch das Glas.
Die Baumwolle erhält in der Küpe eine ungleichmäßige grün- gelbliche
Färbung. Wenn die Baumwolle nach ca. 15 Minuten herausgezogen wird, verfärbt
sich diese schon beim Herausziehen durch Sauerstoffzufuhr langsam blau.
Mit der Zeit wird das Blau immer gleichmäßiger, bis sich nach einer Stunde
ein intensives Dunkelblau ergibt.
1.Farbe und Chromophor
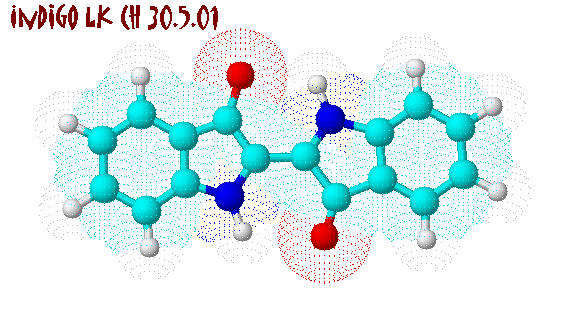
Sauerstoff bildet mit dem ihm gegenüberliegenden Wasserstoff eine
Wasserstoffbrücke, dadurch hat er als Feststoff einen hohen Schmelzpunkt
von 390- 392°C und löst sich überhaupt nicht im Wasser. Durch
die Wasserstoffbrückenbindung wird das Molekül soweit stabilisiert,
dass zwei weitere Sechserringe erkennbar sind. Nun liegt ein System von
6 Ringen vor (4 Sechserringe und 2 Fünferringe) vor, welches hochsymmetrisch
ist. So ergibt sich schon mir nur 9 konjugierten Pi-Bindungen eine tiefe
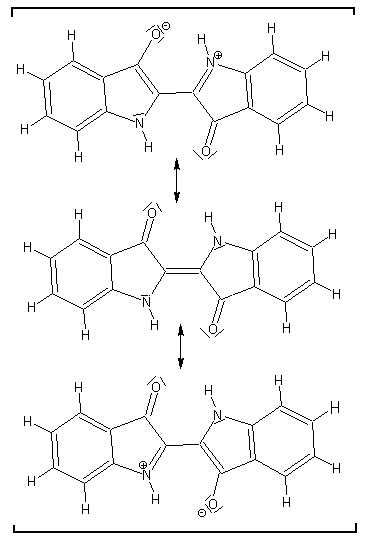
Farbe. Das Chromophor des Indigos wird von zwei überlappenden Trimethinen
(in Form eines H- Chromophors) gebildet.
Als Einzelmolekül kann Indigo nicht in die cis-Form übergehen,
weil zwei intramolekulare Wasserstoffbrücken die trans-Form stärken.
Zum Downloaden:
Das Molekül als ChemSketch
- File (ein Moleküleditor).
2. Verküpung:
Da Indigo ein wasserunlöslicher Stoff ist, kann er nicht direkt zur Färbung eingesetzt werden. Daher muss das Indigo erst einer Reduktion in alkalischer Lösung mit Natriumdithionit (Na2S2O4) unterzogen werden. So wird es wasserlöslich. Dieses wasserlösliche Indigo ist gelblich und nennt sich Leuko-Indigo. Das Gewebe wird mit dem Leuko-Indigo getränkt und an der Luft zum Trocknen aufgehängt. Durch die Sauerstoffzufuhr erfolgt eine Rückoxidation zu Indigo, dem blauen Farbstoff.
Durch eine Redox Reaktion wird das Indigomolekül zu dem gelben und löslichen Leuko-Indigo Molekül reduziert.
Oxidation:
 + 4OH-
==>
2
+ 4OH-
==>
2  + 2e-
+ 2H2O
+ 2e-
+ 2H2O
(Dithionit)
(Sulfit)
Reduktion:
 +2e-
==>
+2e-
==> 
__________________________________________________________________________________________
Redox:
S2O42- +
Indigo +
4OH- ==>
2SO32- +
Leuko-Indigo +
2H2O
3. "Blaumachen":
Der zunächst wasserunlösliche Stoff wird durch Reduktion in alkalischer Lösung mit Natriumdithionit in eine wasserlösliche Form gebracht. Bei Sauerstoffzufuhr erfolgt eine Rückoxidation zum wasserunlöslichen Indigo, dessen Moleküle in den Faserfibrillen mehr oder weniger mechanisch haften bleiben. Die Oxidationsstufe ändert sich beim elementaren Luft - Sauerstoff zu den Hydroxidionen von 0 auf -II, d.h. er wird reduziert und das Leuko-Indigo dafür oxidiert.
2 Leuko - Indigo 2-
Direkt nach der Färbung ist das Blau noch sehr kräftig, damit dieses auch so bleibt, sollte der Stoff mehrmals in Essigwasser gewaschen werden. Doch mit der Zeit, nach öfterem Waschen, reibt sich das Blau mechanisch immer mehr ab. Gerade dadurch erhält man den verwaschenen Jeanseffekt, weshalb sich Indigo in der Mode als Trend bewährt hat.

oben: nach 1 Stunde Luftoxidation
rechts: nach der ersten Wäsche

Auf diesem Bild ist der Chemie LK vom Gymnasium Ohmoor, 2. Semester
beim "Blaumachen" zu sehen!
