Gymnasium Ohmoor - Grundkurs Komplexchemie im 4. Semester - © C.-J. Bautsch GK Chemie 28. April 2002
Berliner Blau mit dem 256000sten Teil eines Nagels
Die Idee und Anregung zu folgendem Versuch stammt von Axel Rex aus "Mein Spiel und Experimentierbuch", erschienen bei Heyne in München 1973. Die komplexchemische Deutung erarbeiteten wir nach Cotton-Wilkonson, "Anorganische Chemie". Verlag Chemie, Basel 1980 und dem neuen Chemie-Basislexikon von Römpp, Thieme, Stuttgart 1998. Der Versuch ermöglicht die Anwendung anorganisch-chemischer Kenntnisse verschiedener Bereiche und erfüllt ästhetische Ansprüche beim Experimentieren.
Einige Nägel, etwa 1g, werden in einem Reagenzglas in ca. 10ml 30%iger Salzsäure gegeben. Die Lösung wird erhitzt, um den Vorgang zu beschleunigen. Es dauert etwa 30 Minuten bis sich die Nägel vollständig gelöst haben. Schließlich werden einige Milliliter konz. Salpetersäure hinzugefügt. Das Reagenzglas wird mit Wasser abgekühlt, bis auf 25 ml aufgefüllt und gut durchgeschüttelt.

* Unter heftiger Gasentwicklung zersetzen sich die Eisennägel in der Salzsäure zu einer klaren, leicht grünlichen Lösung.
* Die Salpetersäurezugabe bewirkt plötzlich eine Ocker- bis Orange - Färbung. Teilweise spritzt die Lösung aus dem Reagenzglas!
* Der Eisennachweis ist sehr empfindlich. Im Bild rechts sind die Uhrgläser im Uhrzeigersinn geordnet. Im ersten Glas gibt es einen so intensiven Niederschlag, dass es fast schwarz erscheint. Mit zunehmender Verdünnung erscheint eine schön gefärbte Lösung von Berliner Blau. Mit etwas Wartezeit (10 Minuten) zeigt sich auch nach dem 9. Schritt noch eine eindeutige, auf die Anwesenheit von Fe3+ - Ionen beruhende Farbreaktion.

1. Die
Eisen-Nägel lösen sich in konz. Salzsäure durch die Oxidationswirkung der
Hydroniumionen:
Fe + 2H3O+
==> Fe2+
+ H2^
+ 2H2O
(U0 H+/H2 = 0,0Volt; U0
Fe/Fe2+ = -0,46Volt)
2. Nitrat vermag im Sauren die Eisen-II-Ionen weiter zu oxidieren, es bildet sich der
Chloropentaquoeisen-III-Komplex:
3Fe2+ + 3Cl- + 4H3O+
+ NO3- + 9H2O
==> 3[Fe(H2O)5Cl]2+
+ NO^
(U0 NO/NO3- = +0,96Volt; U0 Fe2+/Fe3+
= +0,77Volt)
3. Mit Hexacyanoferrat-II - Ionen entsteht das schöne Berliner Blau
[Fe(H2O)5Cl]2+
+ 4K+ + [Fe(CN)6]4- ==>
K+ + [FeFe(CN)6]-
+ 5 H2O +
3K+ + Cl-
Dem Niederschlag weist das Römpp-Lexikon die Verhältnisformel Fe4III[FeII(CN)6]3 zu. In der 3. Gleichung sind wir von der
löslichen Verbindung ausgegangen.
Berliner Blau wird in Druckfarben, in der Automobillackierung und zur
Buntpapierherstellung verwendet.
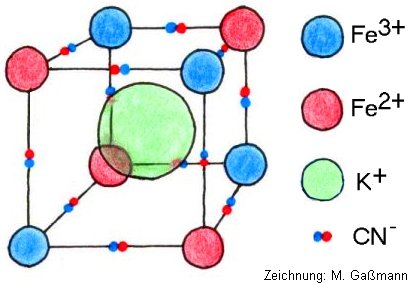
Die Abbildung zeigt den Kristallaufbau von Berliner Blau:
Jedes Eisenion ist oktaedrisch von Cyanid - Liganden umgeben. Es liegt also eine d2sp3 - Hybridisierung vor.
Die Farbigkeit beruht auf den Effekten eines sogenannten Charge - Tranfer - Komplexes. Ein Teil der Lichtenergie (Komplementärfarbe von Blau) bewirkt einen Ladungstransfer von den Fe-II-Ionen zu den gleichberechtigt im Gitter eingebauten Fe-III-Ionen.